1. La résistance à la corrosion
1.1 Résistance générale à la corrosion en applications extérieures des boitiers en aluminium
Généralités sur la corrosion de l’aluminium
L’aluminium et les alliages ont en général une bonne tenue à la corrosion atmosphérique, en milieu marin, urbain, industriel.
Moulés sous pression, les boitiers offrent de nombreuses possibilités de formes et de traitements de la surface, demandent peu d’entretien et résistent bien dans le temps. De plus, dans une optique de développement durable, l’aluminium est un des métaux dont le recyclage est le plus économique. La refusion de l’aluminium ne représente que 5% de l’énergie nécessaire à l’élaboration du métal à partir du minerai. L’aluminium se recouvre naturellement d’une couche d’oxyde, qui le protège le plus souvent contre la corrosion. Dans les solutions aqueuses neutres (4 < pH < 9), ce film d’oxyde a une épaisseur de 50 Å et protège le métal (passivation). L’aluminium n’est corrodé de manière homogène que dans une solution très acide, ou dans une solution alcaline. La résistance et la stabilité de la couche d’oxyde dépendent du milieu ambiant, de la composition de l’alliage et de la structure microscopique du métal (en fonction des traitements thermiques appliqués). Le comportement électrochimique de l’aluminium est influencé par le film d’oxyde naturel qui régit la tenue à la corrosion de l’aluminium.
Les boitiers sont massifs et à parois épaisses (2 à 4mm); la corrosion est alors superficielle et affecte seulement l’aspect, sans modifier la tenue mécanique. Dans les milieux neutres, la vitesse de corrosion générale des alliages d’aluminium passivés est certes très réduite, mais elle n’est néanmoins jamais totalement nulle. Elle garde ainsi une valeur de l’ordre de 5 µm par an, ce qui peut entraîner à la longue une évolution progressive de l’état de surface vers un aspect inesthétique dû à une variation de la rugosité (peau d’orange).
L’altération la plus courante se présente plutôt sous forme d’une corrosion par piqûre qui se développe sous forme de cavités de profondeurs variables. Il s’agit d’un phénomène très complexe, dont le mécanisme n’est pas totalement déterminé.
Dans des milieux industriels courants, les boitiers en aluminium peuvent donc être utilisés sans traitement de surface autre que l’ébavurage et la trovalisation standard.
1.2 Composition chimique
| Matière et norme | Si | Cu | Mg | Zn | Mn | Fe | Ni | Sn | Ti | Al |
| EN AC 44300 DIN 1706 AlSi12(Fe) |
10.5 – 13.5 | <0.10 | – | <0.15 | <0.55 | <1 | – | – | <0.15 | reste |
| ADC12 (JIS H5302:2000) | 9.6 – 12.0 | 1.5 – 3.5 | <0.3 | <1.0 | <0.5 | 0.6 – 0.9 | <0.5 | <0.2 | – | reste |
2. Corrosion galvanique ou corrosion bimétallique
Les boitiers en aluminium peuvent être soumis à un phénomène particulier qui réduit leur durée de vie, peut aller jusqu’à la perforation de l’enveloppe ou au blocage complet des vis de fermeture. C’est la corrosion galvanique ou bimétallique.
Bien que la plupart des normes précisent que des protections appropriées doivent être prises pour éviter la corrosion galvanique sur les boitiers en aluminium, aucune ne préconise de solution ou n’impose de matière ou de composition précise des alliages. Cependant, même si l’aluminium est dans une position défavorable dans l’échelle galvanique, il est le plus souvent recouvert de son film passif, ce qui l’anoblit considérablement et le rend beaucoup moins sensible à la corrosion.
La corrosion galvanique est un phénomène électrochimique qui se produit entre deux métaux différents, lorsque ceux-ci sont en contact, et en présence d’un liquide conducteur (eau, eau de mer) qui assure le contact électrique entre les deux métaux.
Ce phénomène provoquera une corrosion supplémentaire à celle pouvant survenir par d’autres phénomènes et sur des métaux non couplés, et sa progression est en général nettement plus rapide.
Il apparaît une différence de potentiel entre les deux métaux qui dépend à la fois du métal et de la solution. Deux métaux ou deux alliages différents au contact avec le même milieu prennent en général deux potentiels différents. Si ces deux métaux sont reliés électriquement, leur différence de potentiel donne naissance à des réactions électrochimiques et à la circulation d’un courant électrique.
Le métal le plus négatif (le moins noble) est polarisé positivement et le métal le plus positif est polarisé négativement. Dans la très grande majorité des cas, cette configuration correspond à une augmentation de la vitesse de corrosion du métal le plus corrodable (le plus négatif), et à une diminution de la vitesse de corrosion du métal le moins corrodable (le plus positif).
Les conditions conjointes et nécessaires à l’apparition d’un couple de corrosion galvanique.
La corrosion galvanique est fonction de plusieurs facteurs qui doivent être soigneusement évalués lors de l’évaluation de la probabilité d’avoir une corrosion galvanique.
Les conditions conjointes nécessaires sont les suivantes:
– Un pontage par un liquide conducteur (Electrolyte) entre deux métaux
– Un contact électrique entre les deux métaux.
– Une différence de potentiel entre les métaux produisant un courant galvanique significatif
– Une réaction cathodique soutenue sur le plus noble des deux métaux.
NB: Si les métaux sont secs, la corrosion galvanique ne peut pas se produire.
Electrolyte
La conductivité de l’électrolyte conditionne la localisation des dégradations.
Lorsque la conductibilité de l’électrolyte est faible, la corrosion est localisée aux zones de contact entre les deux métaux.
Lorsque la conductivité de l’électrolyte augmente, la surface corrodée augmente.
Contact électrique entre les métaux
Si le contact électrique n’est pas établi entre les deux métaux par l’interposition d’un isolant (oxyde d’aluminium, phosphatation, peinture, huile, etc…), le courant ne circulant pas, il n’y a pas de corrosion.
Différence de potentiel entre les métaux
Plus cette valeur est importante, plus la force électromotrice du phénomène est grande. Une différence de plusieurs centaines de millivolts résultera en une forte corrosion galvanique, alors qu’une différence inférieure à 200-300mV n’aura pas de conséquences importantes.
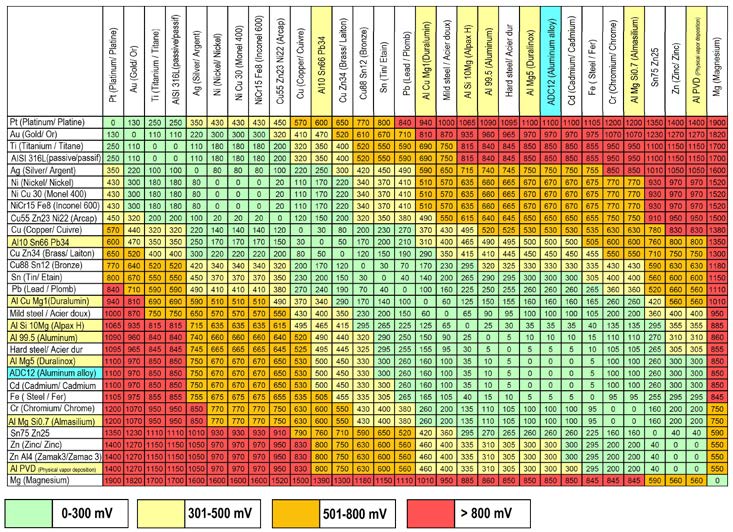
Les potentiels de corrosion galvanique sont donnés par une table qui donne le potentiel électrique des métaux, habituellement mesuré par une technique dite “ Standard Calomel Electrode (S.C.E.)” .
Les métaux dits “Anodiques” ou “non-nobles” ont un potentiel négatif et sont les plus actifs et les métaux dits “cathodiques” ou “nobles” ont un potentiel positif et sont les moins actifs.
Les métaux “Anodiques” tels que le magnésium, le zinc et l’aluminium, seront plus facilement corrodés que les métaux “cathodiques” (Titane, argent, or)
La corrosion est proportionelle à la difference de potentiel entre les deux métaux.
Les valeurs à considérer correspondent aux potentiels des métaux et alliages qui constituent le couple par rapport au milieu considéré. Ces potentiels sont des grandeurs expérimentales et doivent être distingués des potentiels standards des tables thermodynamiques. Les potentiels expérimentaux sont fortement influencés par les paramètres tels que la température, l’agitation et l’aération. Par ailleurs, certains métaux peuvent prendre deux potentiels différents vis-à-vis du même milieu suivant qu’ils sont actifs ou passifs (Cas des aciers inoxydables en contact avec l’eau de mer, par exemple). Ces considérations montrent qu’il peut être difficile de prévoir des tendances sans avoir recours à l’expérimentation, de nombreux paramètres étant susceptibles d’inverser les polarités de certains couples galvaniques.
Les paramètres aggravants ou minorants
– Le rapport des surfaces des deux métaux: le cas le plus défavorable est celui d’une grande surface cathodique (matériau le plus positif) électriquement reliée à une petite surface anodique (métal le plus négatif). La vitesse de corrosion du métal le plus négatif peut être multipliée par 100 voire par 1000.
Par exemple, des vis en acier inoxydable fermant un boitier en aluminium seront peu sujettes à corrosion en raison des différences de surfaces.
Par contre, des vis en acier inoxydable fermant un boitier en aluminium seront beaucoup moins sujettes à corrosion si les surfaces de contact sont réduites au minimum.
Corrosion du métal noble, et influence des sels produits par sa corrosion
– La résistance à la corrosion du métal le plus noble indépendamment de son potentiel, influe de façon considérable sur le comportement du couple bimétallique. Si le métal le plus noble se corrode, ses produits de corrosion risquent, par déplacement, d’accélérer la corrosion du métal le plus corrodable. Par exemple, le cuivre, pourtant considéré comme métal noble et dont le couple galvanique avec l’aluminium est peu important, produit des oxydes qui peuvent corroder l’aluminium, ce qui est un paramètre critique lors de la conception de borniers de terre sur des boîtiers
en aluminium pouvant recevoir des conducteurs en cuivre.
Si le métal noble du couple est incorrodable (Or, Platine), il ne présentera pas de risque de corrosion galvanique quelque soit le métal qui lui sera associé.
Revêtements métalliques sacrificiels
Par application sur l’élément cathodique d’un revêtement sacrificiel ayant un potentiel similaire à celui de l’élément anodique, la corrosion galvanique est fortement diminuée.
Régles principales de conception:
-l’élément sacrificiel doit être du côté anodique et plus petit.
– La couche de revêtement doit être intact, sans fissures ou manques
Exemples:
– Cadmiage sur de la visserie en acier utilisés sur de l’aluminium . Le cadmium sera sacrifié au lieu de corroder l’aluminium. (Différence de potentiel 100 à 200mV )
– Zingage sur de la visserie en acier utilisés sur de l’aluminium. Le zinc sera sacrifié au lieu de corroder l’aluminium (différence de potentiel 0,1 à 0,2 V).
Attention:
Ne pas utiliser de nickelage sur de la visserie en acier. La différence de potentiel (450mV) entre le nickel et l’aluminium est trop élevée et l’aluminium se corrodera
Note: La tendance actuelle est la recherche d’alternative au cadmium à cause de sa toxicité, et son interdiction par la Directive Européenne Rohs
3. Cas particulier de la corrosion galvanique entre acier inoxydable et aluminium
Les potentiels de corrosion des aciers inoxydables sont «cathodiques» et situés dans la zone “noble” et les potentiels de corrosion de l’aluminium sont “anodiques” et situés dans le zone “non-noble”, avec une forte différence de potentiel. Cela signifie qu’il n’y aura pas de corrosion galvanique sur l’acier inoxydable lorsqu’il est placé en contact avec de l’aluminium alors que l’aluminium se corrodera.
Cependant, de grandes surfaces relatives d’aluminium en contact avec des surfaces faibles d’acier inoxydable peuvent être acceptables.
L’utilisation de visserie en acier inoxydable sur des pièces massives, plaques ou feuilles d’aluminium est normalement considérée comme sûre, contrairement à l’inverse.
Même en l’absence d’isolation entre les métaux, il y a peu de risques de corrosion dans un climat continental.
En revanche, dans un environnement marin, d’importantes corrosions par piqûres localisées sur des taraudages aluminium ont été observées alors que des vis en acier inoxydables étaient utilisées.
Moyens mécaniques de prévention de la corrosion galvanique entre l’aluminium et l’acier inoxydable
– Isoler les deux matériaux à l’aide d’un matériau isolant électrique, comme le plastique, à mesure du possible
– Éviter les zones où sont en contact des surfaces relativement petites de métal le moins noble (Aluminium) et de vastes zones du métal plus noble (acier inoxydable).
– Utiliser le même métal ou un métal plus noble pour la visserie, clips et boulons.
– Éviter d’utiliser des pièces en acier inoxydable comportant des crevasses: En présence de crevasses les aciers inoxydables peuvent présenter des potentiels moins élevés à cause de l’appauvrissement en oxygène à l’intérieur de la crevasse. Le couplage d’une zone relativement large d’aluminium avec une faible surface d’une pièce en acier inoxydable crevassée peut provoquer une attaque rapide de la matière à l’intérieur de la crevasse et corroder l’acier inoxydable.
– Empêcher la présence électrolyte autour de la jonction bimétallique par exemple avec de la peinture. Peindre les deux métaux si possible. Si c’est impossible, peindre le métal le plus noble
– Étancher: s’assurer que les surfaces de contact sont étanches.
– Appliquer des inhibiteurs de corrosion ou sous les têtes de vis ou de boulons insérés dans des surfaces de métaux différents, que les surfaces aient été on non préalablement revêtus ou traitées.
– Dans certains cas, il peut être possible d’appliquer un revêtement organique isolant sur les surfaces de contact avant l’assemblage. (Cas de joints qui ne doivent pas être conducteur de l’électricité.
– Lorsque cela est possible ou si cela n’interfère pas avec l’utilisation de l’assemblage, le joint externe doit être recouvert extérieurement d’une peinture efficace.
– Éviter les raccords filetés pour les matériaux très éloignés dans la série galvanique
Limitation du couple galvanique par la protection de l’aluminium et de l’acier inoxydable par des traitements de conversion chimique de surface
La phosphatation de l’acier et de l’acier inoxydable
La phosphatation est un traitement de conversion utilisé pour former des couches obtenues par une réaction du substrat avec un milieu choisi. La phosphatation est appliquée notamment aux aciers au carbone et aux aciers inoxydables. Dans le cas des pièces en acier, la phosphatation sert essentiellement à renforcer l’adhésion des peintures.
On distingue les couches de phosphates minces (0.2‐0.8 g/m2) essentiellement composées de phosphates de fer, les couches de phosphates d’épaisseur moyenne (1.5‐4 g/m2) qui contiennent du phosphate de zinc, et les couches de phosphates lourdes (7‐30 g/m2).
Ces dernières, constituées de phosphates de fer, de zinc et de manganèse peuvent servir comme revêtement anticorrosion, même en l’absence de peinture
Dans le cas des assemblages aluminium‐acier inoxydable, la phosphatation moyenne ou épaisse des pièces en acier est recommandée.
Cependant, l’idéal reste de traiter les deux structures par phosphatation, séparément puisque les procédés sont différents pour l’aluminium et l’acier.
La phosphatation de l’aluminium
La phosphatation de l’aluminium a pris une place importante dans les traitements de surface suite à l’utilisation conjointe de ce métal avec l’acier dans la construction automobile. Le métal est plongé dans une solution d’acide phosphorique dans laquelle il se corrode. Lors de l’attaque de l’aluminium, de l’hydrogène est libéré, ce qui entraîne une augmentation locale du pH et par conséquent le dépôt de triphosphates peu solubles. D’autres ions peuvent être ajoutés aux bains Zn mais aussi Mn et Ni. Les couches obtenues, contrairement aux couches de phosphochromatation qui sont amorphes, sont formées de petites cristaux de phosphates de Zn (Mn Ni). La germination de ces cristaux est favorisée par immersion du métal dans une solution colloïdale de phosphate de titane.
L’anodisation de l’aluminium
L’anodisation, consiste à renforcer le film d’oxyde naturel par une oxydation anodique. L’anodisation épaisse procure une bonne isolation galvanique
Le raccordement de métaux par des pièces non métalliques
Pour être apte à raccorder des métaux, des matériaux non métalliques doivent être:
– sans agents corrosifs (sels)
– sans acide ou produits alcalins (pH neutre)
– sans carbone, graphite ou particules métalliques
– Ne doivent pas être biodégradables
– Ne pas favoriser la croissance fongique
– Ne pas absorber l’eau ou avoir une action capillaire
– Ne pas comporter de matériaux non métalliques qui vont initier la corrosion de métaux à laquelle ils sont reliés, par exemple, plastiques cellulosiques, plastiques chargés fibres de carbone, plastiques chargés de matériaux métalliques, ainsi que les matériaux composites en amiante-ciment
4. Table des couples électrochimiques entre alliages d’aluminium
(Noms surlignés en jaune et bleu) et d’autres métaux usuels, dans une solution d’eau saline à 2%.
Il n’y a pas d’apparition de corrosion notable lorsque la valeur du couple galvanique est inférieure à 300mV
4.1 Autres limitations dans l’utilisation des alliages d’aluminium
Afin d’éviter des risques d’inflammation dus aux chocs ou au frottement, les normes destinées au matériel antidéflagrant (IEC 60079-0) limitent l’usage de l’aluminium.
Pour les enveloppes destinées au groupe I:
Le poids total de l’aluminium + magnésium +titane ne doit pas dépasser 15% du poids total (ou 6% du poids total du magnésium +titane pour les alliages ne comportant pas d’aluminium), ce qui élimine, pour ce groupe, la plupart des alliages comportant de l’aluminium.
Pour les enveloppes destinées au groupe II:
– Pour la zone 0: le poids total de l’aluminium + magnésium +titane +zirconium ne doit pas dépasser 10% du poids total (ou 7.5% du poids total du magnésium +titane +zirconium pour les alliages ne comportant pas d’aluminium), ce qui élimine, pour ce groupe et cette zone la plupart des alliages comportant de l’aluminium
– Pour la zone1: le poids de magnésium ne doit pas dépasser 7.5% du poids total
Pour la zone 2: pas de spécifications particulières.
